Clinical Genetics & Genomics Department
ΕΡΕΥΝΑ, Μελέτη οικογενών μετατοπίσεων - Ανίχνευση γονιδιακών μεταλλάξεων σε ασθενείς με οικογενείς ισοζυγισμένες μετατοπίσεις

Οι φαινομενικά ισοζυγισμένες μετατοπίσεις είναι χρωμοσωμικές ανωμαλίες που επηρεάζουν τη δομή των χρωμοσωμάτων αλλά δεν προκαλούν κάποια εμφανή προσθήκη ή απώλεια γενετικού υλικού. Συνεπώς, οι περισσότεροι φορείς αυτού του είδους των αναδιατάξεων είναι φαινοτυπικά υγιείς. Ωστόσο σε κάποιες περιπτώσεις (~6-20%) μπορεί να υπάρχουν και κλινικά χαρακτηριστικά όπως νοητική υστέρηση, ψυχοκινητικές διαταραχές, πολλαπλές συγγενείς ανωμαλίες κ.ά. [1]. Επίσης, οι ισοζυγισμένες μετατοπίσεις μπορούν να κληρονομηθούν στους απογόνους υγιών φορέων σε μη ισορροπημένη μορφή με αποτέλεσμα τη δημιουργία εμβρύων με έλλειμμα ή διπλασιασμό γενετικού υλικού ή την πρόκληση πολλαπλών αποβολών.
Διερεύνηση φαινομενικά ισοζυγισμένων μετατοπίσεων στο τμήμα Κυτταρογενετικής και Γονιδιωματικής
Το τμήμα Κυτταρογενετικής και Γονιδιωματικής του Ινστιτούτου Νευρολογίας & Γενετικής Κύπρου προσφέρει ένα ευρύ φάσμα κυτταρογενετικών και μοριακών εξετάσεων, σε διαγνωστικό και ερευνητικό επίπεδο, σχετικά με την γενετική αιτιολογία νοητικών και νευρολογικών διαταραχών, συνδρόμων με πολλαπλές συγγενείς ανωμαλίες, υπογονιμότητας, απώλειας εγκυμοσύνης κ.ά. Στα πλαίσια μιας μεγάλης έρευνας του τμήματος, μελετήθηκαν λεπτομερώς τα σημεία θραύσης φαινομενικά ισοζυγισμένων μετατοπίσεων, σε άτομα με κλινικό φαινότυπο, με τη μέθοδο αλληλούχισης DNA νέας γενιάς ολόκληρου γονιδιώματος (Whole-Genome Sequencing, WGS) [2,3]. Σκοπός ήταν η διερεύνηση των μοριακών μηχανισμών που οδήγησαν στη δημιουργία των ανωμαλιών αλλά και η ταυτοποίηση των γενετικών λαθών που πιθανόν να ευθύνονται για την κλινική εικόνα του κάθε ατόμου. Σε ασθενείς με μη-οικογενείς ισοζυγισμένες μετατοπίσεις, δηλαδή σε αυτούς όπου οι χρωμοσωμικές ανωμαλίες δεν κληρονομήθηκαν αλλά εμφανίστηκαν μεμονωμένα, καταφέραμε να περιγράψουμε τους μοριακούς μηχανισμούς που συνδέουν άμεσα ή έμμεσα τις ίδιες τις μετατοπίσεις με την κλινική εικόνα των ασθενών [2]. Σε ασθενείς με οικογενείς ισοζυγισμένες μετατοπίσεις, δηλαδή σε αυτούς όπου πανομοιότυπες χρωμοσωμικές ανωμαλίες κληρονομήθηκαν από υγιείς γονείς, μελετήθηκαν οι ίδιοι μοριακοί μηχανισμοί αλλά αποδείχθηκε ότι αυτοί δεν ευθύνονταν για τον φαινότυπο του κάθε ασθενή [3].
Στη συνέχεια, οι ίδιες οικογένειες που παρέμειναν αδιάγνωστες υποβλήθηκαν σε μια πιο στοχευμένη ανάλυση, η οποία επικεντρώνεται αποκλειστικά στην ανίχνευση μεταλλάξεων εντός των εξωνίων του γονιδιώματος (Whole Exome Sequencing, WES). Στόχος της ανάλυσης αυτής ήταν να διερευνηθεί η πιθανότητα ύπαρξης γονιδιακών μεταλλάξεων που να εξηγούν τη διαφορετική κλινική εικόνα σε μέλη της ίδιας οικογένειας με πανομοιότυπες ισοζυγισμένες μετατοπίσεις. Τα αποτελέσματα της εν λόγω έρευνας έχουν δημοσιευτεί πρόσφατα στο έγκριτο διεθνές επιστημονικό περιοδικό MDPI Genes [4]. Συγκεκριμένα, εντοπίστηκαν δυνητικά υπαίτιες μεταλλάξεις σε τρεις από τις τέσσερις οικογένειες που μελετήθηκαν. Ενδεικτικά, αναφέρουμε το πιο κάτω παράδειγμα.
Σε ασθενή που φέρει οικογενή μετατόπιση t(1;7)(p36.1;q22)mat, ανακαλύψαμε μια νέα παθογόνα μετάλλαξη NM_003165.6:c.1110+2T>G που επηρεάζει την διαδικασία συναρμογής (ή ωρίμανσης του RNA) του γονιδίου STXBP1 (Εικόνα 1Α). Η επίδραση της μετάλλαξης αυτής μελετήθηκε περαιτέρω με reverse transcription PCR χρησιμοποιώντας RNA του ασθενούς. Τα αποτελέσματα έδειξαν ότι 22 νουκλεοτίδια από το ιντρόνιο 13 του γονιδίου κατέληξαν στο ώριμο αγγελιαφόρο RNA (mRNA) (Εικόνα 1Β), με αποτέλεσμα να προκαλείται προβλεπόμενος πρώιμος τερματισμός της πρωτεΐνης (NP_003156.1:p.(Asp371GlyfsTer16)). Η πρωτεΐνη STXBP1 έχει σημαντικό ρόλο στη σύντηξη συναπτικών κυστιδίων με τη μεμβράνη και ρύθμιση έκλυσης νευροδιαβιβαστών [5]. Ετερόζυγες μεταλλάξεις και ελλείμματα στο γονίδιο STXBP1 έχουν αναφερθεί σε ασθενείς με αναπτυξιακή και επιληπτική εγκεφαλοπάθεια 4 (OMIM # 612164) [6]. Συνεπώς, η νοητική και αναπτυξιακή υστέρηση καθώς και επιληψία που έχουν παρατηρηθεί στον ασθενή μας συνάδουν με την κλινική εικόνα που συσχετίζεται με δυσλειτουργία του γονιδίου STXBP1.
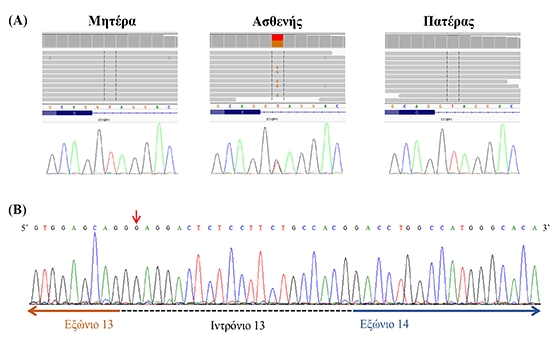
Εικόνα 1: Α) Απεικόνιση της ετερόζυγης STXBP1 μετάλλαξης που εντοπίστηκε και επιβεβαιώθηκε στον ασθενή με τις μεθόδους WES και Sanger sequencing, αντίστοιχα. Οι γονείς δεν ήταν φορείς της μετάλλαξης. Β) Επίδραση της STXBP1 μετάλλαξης (κόκινο βέλος) σε επίπεδο RNA. Είκοσι δύο νουκλεοτίδια από το ιντρόνιο 13 ενσωματώθηκαν μεταξύ των εξωνίων 13 και 14 στο mRNA του ασθενούς.
Συμπέρασμα
Εις βάθος διερεύνηση με τη μέθοδο WES έδειξε ότι σε οικογένειες με πανομοιότυπες ισοζυγισμένες μετατοπίσεις, η διαφορετική κλινική εικόνα οφείλεται σε δυνητικά υπαίτιες γονιδιακές μεταλλάξεις που προκύπτουν ανεξάρτητα από την κοινή χρωμοσωμική ανωμαλία και που παρατηρούνται αποκλειστικά στον ασθενή και όχι στους υγιείς γονείς/συγγενείς. Το τμήμα διερευνά περισσότερες οικογένειες που θα ενισχύσουν τα αποτελέσματα της παρούσας έρευνας, επιτρέποντας καλύτερη κατανόηση των εμπλεκόμενων γενετικών μηχανισμών σε περιπτώσεις με οικογενείς ισοζυγισμένες μετατοπίσεις και διαφορετικούς φαινότυπους. Η νέα αυτή γνώση θα συμβάλει σημαντικά στην αναβάθμιση της προγεννητικής διάγνωσης και κλινικής συμβουλευτικής σε άτομα/οικογένειες που φέρουν φαινομενικά ισοζυγισμένες μετατοπίσεις.
Άρθρο
Κωνσταντία Αριστείδου
Associate Scientist
Τμήμα Κλινικής Γενετικής και Γονιδιωματικής
Συντονίστρια έρευνας:
Καρολίνα Σισμάνη
Διευθύντρια Τμήματος Κυτταρογενετικής και Γονιδιωματικής
Βιβλιογραφία
- Halgren, C.; Nielsen, N.M.; Nazaryan-Petersen, L.; Silahtaroglu, A.; Collins, R.L.; Lowther, C.; Kjaergaard, S.; Frisch, M.; Kirchhoff, M.; Brøndum-Nielsen, K.; et al. Risks and Recommendations in Prenatally Detected De Novo Balanced Chromosomal Rearrangements from Assessment of Long-Term Outcomes. Am. J. Hum. Genet. 2018, 102, 1090-1103, doi:10.1016/j.ajhg.2018.04.005.
- Aristidou, C.; Theodosiou, A.; Bak, M.; Mehrjouy, M.M.; Constantinou, E.; Alexandrou, A.; Papaevripidou, I.; Christophidou-Anastasiadou, V.; Skordis, N.; Kitsiou-Tzeli, S.; et al. Position effect, cryptic complexity, and direct gene disruption as disease mechanisms in de novo apparently balanced translocation cases. PLoS One 2018, 13, e0205298, doi:10.1371/journal.pone.0205298.
- Aristidou, C.; Koufaris, C.; Theodosiou, A.; Bak, M.; Mehrjouy, M.M.; Behjati, F.; Tanteles, G.; Christophidou-Anastasiadou, V.; Tommerup, N.; Sismani, C. Accurate Breakpoint Mapping in Apparently Balanced Translocation Families with Discordant Phenotypes Using Whole Genome Mate-Pair Sequencing. PLoS One 2017, 12, e0169935, doi:10.1371/journal.pone.0169935.
- Aristidou, C.; Theodosiou, A.; Alexandrou, A.; Papaevripidou, I.; Evangelidou, P.; Kosmaidou-Aravidou, Z.; Behjati, F.; Christophidou-Anastasiadou, V.; Tanteles, G.A.; Sismani, C. Exploring the Genetic Causality of Discordant Phenotypes in Familial Apparently Balanced Translocation Cases Using Whole Exome Sequencing. Genes 2022, 14, doi:10.3390/genes14010082.
- Han, G.A.; Malintan, N.T.; Collins, B.M.; Meunier, F.A.; Sugita, S. Munc18-1 as a key regulator of neurosecretion. J. Neurochem. 2010, 115, 1-10, doi:10.1111/j.1471-4159.2010.06900.x.
- Saitsu, H.; Kato, M.; Mizuguchi, T.; Hamada, K.; Osaka, H.; Tohyama, J.; Uruno, K.; Kumada, S.; Nishiyama, K.; Nishimura, A.; et al. De novo mutations in the gene encoding STXBP1 (MUNC18-1) cause early infantile epileptic encephalopathy. Nat. Genet. 2008, 40, 782-788, doi:10.1038/ng.150.











0002.jpg)
