Neuropathology Department
ΕΡΕΥΝΑ, Στη μάχη κατά της Νόσου Αλτσχάιμερ

Η νόσος του Αλτσχάιμερ είναι μια σποραδική ή οικογενής προοδευτική νευροεκφυλιστική ασθένεια του εγκεφάλου που προκαλεί την πιο συχνή μορφή άνοιας. Είναι η έκτη αιτία θανάτου στο γενικό πληθυσμό καθώς επίσης και η πέμπτη κύρια αιτία θανάτου σε άτομα ηλικίας άνω των 65 ετών. Σήμερα, αποτελεί πλέον μια παγκόσμια επιδημία που πλήττει πάνω από 47 εκατομμύρια ανθρώπους παγκοσμίως. Ο αριθμός αυτός προβλέπεται να φθάσει τα 76 εκατομμύρια μέχρι το 2030 (www.alz.org). Επιπλέον, η νόσος του Αλτσχάιμερ επιφέρει ένα τεράστιο οικονομικό κόστος στους ασθενείς και στις οικογένειές τους αλλά και στα γενικά συστήματα υγείας με αυξητική τάση. Το σημερινό κόστος της νόσου στην Ευρώπη είναι περίπου 200 δισ. Ευρώ και προβλέπεται να φθάσει τα 250 δισ. Ευρώ έως το έτος 2030 (www.alzheimer-europe.org), ενώ το κόστος στις ΗΠΑ είναι 290 δισ. Δολάρια για το έτος 2019 (Alzheimer's Association, alz. org). Πρέπει να σημειωθεί ότι προβλέπεται αύξηση κατά 43% του αναμενόμενου κόστους από το 2008 έως το 2030, αντανακλώντας την εκθετική αύξηση τόσο των ασθενών με Αλτσχάιμερ όσο και των αναγκών τους.
Επί του παρόντος δεν υπάρχει καμία πραγματικά αποτελεσματική θεραπεία για το Αλτσχάιμερ και όταν ένα άτομο αρχίζει να εμφανίζει συμπτώματα, όπως η απώλεια μνήμης, ακολουθεί μια αναπόφευκτη προοδευτική πορεία μέχρι την κατάληξη του ασθενούς. Ως εκ τούτου, οι επιπτώσεις στην ποιότητα ζωής τόσο των ασθενών όσο και των οικογενειών / φροντιστών τους είναι πραγματικά τεράστιες.
Το κύριο χαρακτηριστικό της παθολογικής διαδικασίας της νόσου είναι η εξωκυτταρική εναπόθεση πλακών αμυλοειδούς (Αβ) στο παρέγχυμα του εγκεφάλου που προκαλείται από την πρωτεολυτική διάσπαση της πρωτεΐνης amyloid precursor (ΑΡΡ) στη μεμβράνη των νευρώνων του εγκεφάλου. Γενετικές μεταλλάξεις στη Πρόδρομη πρωτεΐνη του αμυλοειδούς (ΑΡΡ) η σε ορισμένα γονίδια που εμπλέκονται στο μεταβολισμό της ΑΡΡ (π.χ. PSEN1 / 2), ή οι σχετιζόμενες με την ηλικία αλλαγές στο μεταβολισμό της ΑΡΡ, οδηγούν είτε σε αυξημένη παραγωγή είτε σε μειωμένη εξάλειψη του διαλυτού Αβ αμυλοειδούς, προκαλώντας στη συνέχεια την εναπόθεση πλακών Αβ. Αξιοσημείωτο είναι το γεγονος ότι η εναπόθεση αμυλοειδούς ξεκινάει μέχρι και είκοσι χρόνια πριν από τη διάγνωση των συμπτωμάτων.
Μελέτες σε ασθενείς με Αλτσχάιμερ και διαγονιδιακά μοντέλα ποντικών έδειξαν διήθηση ανοσοκυττάρων σε πλάκες Αβ. Αυτά τα κύτταρα αποτελούνται από ενεργοποιημένα μικρογλοία και ενεργά αστροκύτταρα τα οποία αποτελούν βασικούς πυλώνες στη ρύθμιση και φυσιολογική λειτουργία των νευρώνων του εγκεφάλου . Τα ενεργοποιημένα μικρογλοία έχουν το σημαντικό ρόλο της φαγοκυττάρωσης και καταστροφής «ξένων» σωματιδίων, όπως το Αβ αμυλοειδές, από το παρέγχυμα του εγκεφάλου. Επιπλέον, υπάρχουν ενδείξεις ότι περιφερικά φαγοκύτταρα μπορούν να εισέλθουν στον εγκέφαλο διαμέσου του αιματοεγκεφαλικού φραγμού. Λαμβάνοντας υπόψη αυτά τα δεδομένα η ενίσχυση της φαγοκύτωση ίσως μπορεί να χρησιμοποιηθεί ενεργοποιώντας της θεραπευτικά.
Το σύστηµα του συµπληρώµατος αποτελείται από 35 περίπου διαλυτές και µεβρανικές πρωτεΐνες που εκφράζονται κυρίως, από ηπατοκύτταρα αλλά και µονοκύτταρα, µακροφάγα και επιθηλιακά κύτταρα του γαστρεντερικού, νευρικού και ουροποιητικού συστήµατος. Οι πρωτεΐνες του συμπληρώματος συμμετέχουν στη διαδικασία αντιμετώπισης των παθογόνων μικροοργανισμών, καταστρέφοντάς τους με διάφορους τρόπους.
Το σύστηµα του συµπληρώµατος έχει αποδειχθεί ότι ενεργοποιείται από τα πρώιμα στάδια του Αλτσχάιμερ. Η πρωτεΐνη του συμπληρώματος C5a πιστεύεται ότι ενεργοποιεί τους C5a υποδοχείς σε φαγοκύτταρα, όπως τα μικρογλοία, και να αυξάνει τη φαγοκυττάρωση του Αβ. Ο υποδοχέας C5a βρίσκεται σε παρα πολλά κύτταρα που εμπλέκονται στην φαγοκυττάρωση σε φυσιολογικές η παθολογικές διαδικασίες. Πιο συγκεκριμένα, οι υποδοχείς C5a βρίσκονται σε κοκκιοκύτταρα, μονοκύτταρα/μακροφάγα, δενδριτικά κύτταρα, αστροκύτταρα και μικρογλοία. Η πρωτεΐνη C5a είναι ένα εξαιρετικά φλεγμονώδες μόριο που ενισχύει την ενεργοποίηση του συμπληρώματος, προσελκύει ανοσοκύτταρα και ακόμη απελευθερώνει ισταμίνη σε αλλεργικές αντιδράσεις. Επομένως, η C5a μπορεί να χαρακτηριστεί ταυτόχρονα ως μια αναφυλατοξίνη και ως μια χημειοελκυστική ουσία, η οποία είναι απαραίτητη για την ανοσολογική αντίδραση του εγκεφάλου στη παρουσία «ξένων» σωματιδίων.
Το φάρμακο ΕΡ67 είναι ένα ανάλογο της πρωτεΐνη C5a και δρα σαν αγωνιστής του υποδοχέα C5a, ενισχύοντας την δράση των κύτταρων που ενεργοποιούνται. Έχουμε χορηγήσει αυτή την ουσία σε διαγονιδιακά ποντίκια που εμφανίζουν νόσο ανάλογη του Αλτσχάιμερ (5XFAD). Κατά τη διάρκεια της μελέτης αξιολογήθηκαν αρκετοί νευρωνικοί και νεύρο-φλεγμονώδεις δείκτες καθώς και η λειτουργία της βραχυπρόθεσμης μνήμη (που επηρεάζεται από την εναπόθεση του Αβ αμυλοειδούς). Η θεραπεία με ΕΡ67 ενίσχυσε τη φαγοκυττάρωση, με αποτέλεσμα τη σημαντική μείωση των πλακών Αβ, της αστροκυττάρωσης και την απώλεια συνάψεων που είναι από τους χαρακτηριστικούς ιστολογικούς δείχτες της νόσου. Παράλληλα το ΕΡ67 προστάτεψε τα ποντίκια από την αναμενόμενη απώλεια στη βραχυπρόθεσμη μνήμη.
Τα αποτελέσματα της μελέτης αποδειχνόσουν ότι η ενεργοποίηση της φαγοκύτωσης μέσω κύτταρων που κατέχουν υποδοχείς του C5a ίσως να προσφέρει μια νέα θεραπευτική οδό προς την ίαση της νόσου του Αλτσχάιμερ νοουμένου βέβαια της έγκαιρης χορήγησης του στην προ συμπτωματική φάση της νόσου. Η έγκαιρη διάγνωση της νόσου είναι δυνατόν να γίνει με ειδικές αναλύσεις αίματος και απεικονίσεις του εγκεφάλου. Ένα άλλο πλεονέκτημα του ΕΡ67 είναι ότι η χορήγηση του έγινε δια του στόματος.
Η μελέτη έχει δημοσιευθεί στο επιστημονικό περιοδικό PLOS ONE ως μέρος μιας ειδικής έκδοσης με τίτλο: “Early diagnosis and treatment of Alzheimer’s disease”.
“C5aR agonist enhances phagocytosis of fibrillar and non-fibrillar Aβ amyloid and preserves memory in a mouse model of familial Alzheimer’s disease”
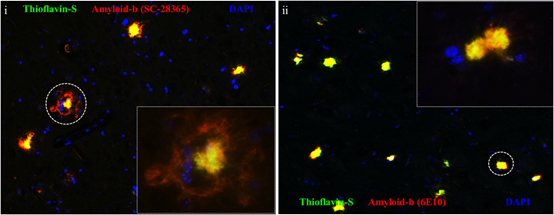
Πλάκες αμυλοειδούς στον εγκέφαλο διαγονιδιακού μοντέλου του Αλτσχάιμερ.
Έλενα Παναγιώτου Worth
Associate Scientist
Neuropathology Laboratory











0002.jpg)
